10月6日,我校生命科学学院王水研究员团队在Genome Biology发表了题为“A nucleoporin-associated signaling cascade controls plant immunity via histone modification”的研究论文。该文通过遗传学、分子生物学与表观遗传学结合的方法,系统解析了一条以核孔蛋白CPR5/GBPL3为核心的信号级联通路,揭示了“核孔运输–RNA加工–组蛋白修饰”协同调控植物免疫核心转录因子 SARD1/CBP60g 基因转录的分子机制,填补了从免疫受体激活到关键转录因子表达调控之间的关键空白。
植物如何抵抗病害?通常植物通过两层先天免疫系统抵御病原微生物入侵:由细胞表面受体PRR介导的PTI,以及由细胞内受体NLR介导的ETI。无论是PRR还是NLR的激活,都会引发植物基因组层面的大规模转录重编程。CBP60家族的两个功能冗余的转录因子SARD1和CBP60g是这一过程的核心调控因子。近年研究发现,激活后的NLR可寡聚化形成钙离子通道,而CBP60家族作为钙信号感知元件可能参与解码此类信号。因此,SARD1/CBP60g是免疫受体PRR/NLR下游激活植物免疫反应的核心因子。然而,SARD1和CBP60g基因自身的转录调控机制仍不清楚,成为理解植物免疫调控网络的关键缺失环节。
核孔复合体(NPC)是核质运输的关键通道。RNA结合蛋白CPR5是植物NPC的一个组分,在病原微生物侵染后可被激活的NLR诱导发生构象变化,由寡聚体转为单体,从而促进免疫信号核质运输并激活ETI。最近发现,CPR5通过GBP(GTP结合蛋白)家族的GBPL3调控植物免疫。在哺乳动物中,干扰素诱导的GBP是调控细胞自主性先天免疫的关键因子。GBPL3也是植物NPC的一个组分,可与组蛋白修饰因子PRC2形成复合体,并能直接结合SARD1 和 CBP60g基因 。因此,核孔蛋白CPR5/GBPL3可能通过组蛋白修饰调控SARD1 和 CBP60g基因的转录。

核心发现一:核孔不只是 “通道”,更是 “信号枢纽”
之前的遗传分析表明CPR5通过RNA加工复合体NTC和CPSF调控植物免疫。PRL1和FIP1分别是NTC和CPSF复合体的核心因子。该文进一步筛选prl1 fip1双突变体的回复子spaf(suppressor of prl1 and fip1)(图1A)。通过DNA-seq分析以及基因互补验证,鉴定出四个关键SPAF基因:DRC2、JMJ14、YAF9A和 ICU11,它们都编码与组蛋白修饰相关的蛋白。引人注目的是,这些蛋白均为已知的GBPL3复合体组分(图1B)。后续实验证实,GBPL3本身亦为SPAF因子。同时,该实验室也发现GBPL3介导拟南芥GBP家族另一个成员GBPL2调控CPR5免疫信号途径。进一步研究发现,这些组蛋白修饰因子与核孔蛋白CPR5、GBPL3及RNA加工因子NTC/CPSF共同构成一个超大复合体——将其命名为“植物CPR5免疫信号模块(Plant CPR5 Immune Signaling Module,PRISM)”。通过酵母双杂交、BiFC、Co-IP等实验,验证了PRISM各组分间的相互作用。该复合体主要定位于核膜和核斑点,是连接核孔运输与表观调控的关键结构基础(图1C)。
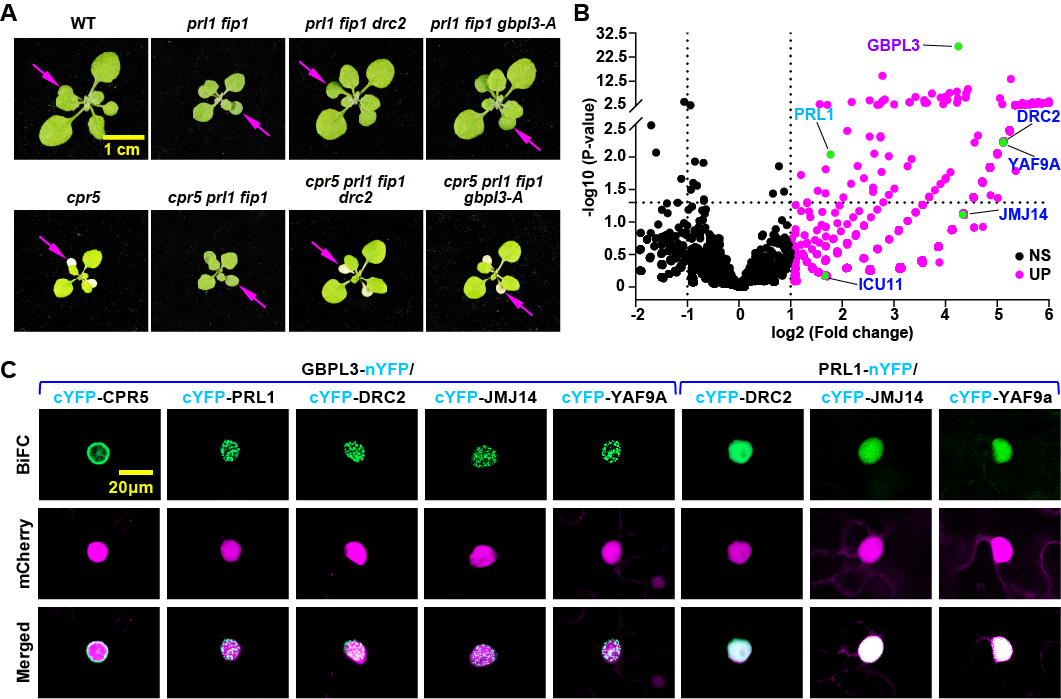
图1. PRISM复合体成员之间的遗传关系和蛋白互作。(A)prl1 fip1双突变体的EMS诱变和回复子spaf(suppressor of prl1 and fip1)筛选。(B) 火山图展示以GBPL3为诱饵,通过Proximity labeling proteomics技术纯化的GBPL3复合体候选蛋白。(C)YFP的双分子荧光互补(BiFC-YFP)分析。mCherry-NLS作为细胞核定位标记。
核心发现二:植物免疫“刹车”的信号链——核孔蛋白为中心的超级复合体PRISM通过组蛋白修饰抑制 SARD1和CBP60g 基因的转录
RNA-seq分析显示,多个系统获得性抗性(SAR)核心调控因子(如CBP60g、FMO1、ICS1、SARD1和SARD4)的表达受CPR5-NTC/CPSF信号链调控。采用CRISPR/Cas9技术在 cpr5突变体背景中敲除这些因子的基因。在cpr5突变体中,防御相关基因PR1与PR2表达显著上升,而在引入sard1 cbp60g双突变后,该表型被完全抑制(图2A)。AraENCODE数据显示,无病原侵染时,SARD1/CBP60g位点受抑制型组蛋白修饰H3K27me3(图2B);侵染后,NLR激活导致CPR5构象变化,释放PRISM中的NTC/CPSF及CKIs,削弱GBPL3与组蛋白修饰因子对SARD1/CBP60g的结合,从而增强H3K4me3修饰,激活转录。ChIP-seq分析揭示,cpr5突变体中激活型组蛋白修饰H3K4me3水平升高,该现象在cpr5 prl1 fip1中被逆转,而在cpr5 prl1 fip1 jmj14中再次上升(图2C-2D)。GO分析表明,受CPR5-NTC/CPSF-GBPL3/SPAFs信号链调控的H3K4me3修饰基因显著富集于免疫信号通路,包括SARD1与CBP60g。病原菌侵染促进PRISM结合SARD1/CBP60g基因并伴随H3K4me3修饰上升。这些发现揭示PRISM复合体形成一个“核孔蛋白-RNA加工-组蛋白修饰”的核心信号链,通过组蛋白修饰调控SARD1和CBP60g基因的转录,从而激活植物免疫相关的大规模转录重编程。
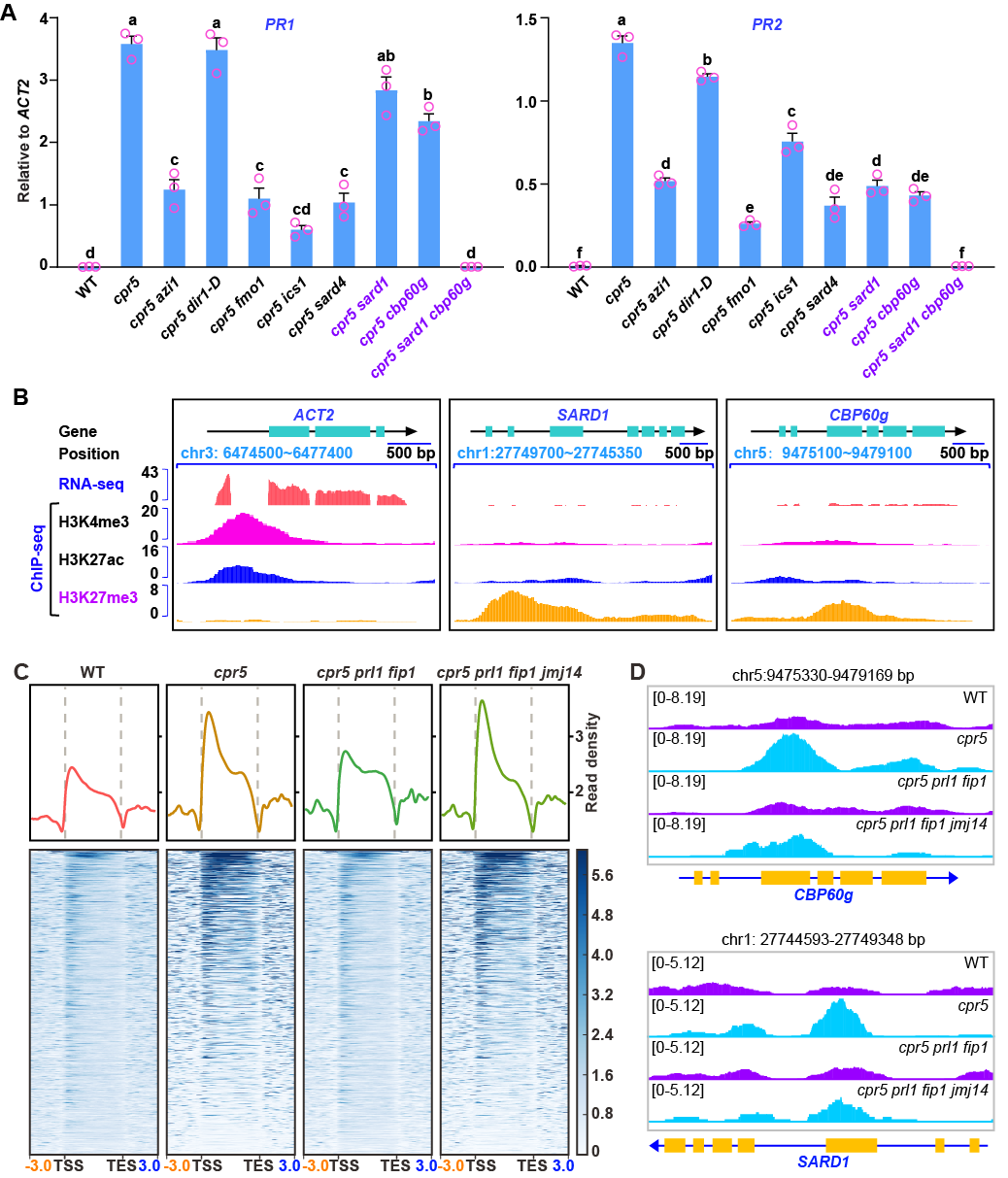
图2. PRISM通过SARD1和CBP60g调控植物免疫反应。(A)qRT-PCR分析,以ACT2作为内参基因。(B)RNA-seq与ChIP-seq分析:ACT2、SARD1和CBP60g基因,数据来源于AraENCODE数据库。(C)Metaplots(上图)和Heatmaps (下图):H3K4me3 ChIP-seq信号分布。(D)Genome browser图:SARD1和CBP60g基因上的H3K4me3 ChIP-seq信号分布。
综上所述,该文的研究不仅揭示了核孔蛋白在表观遗传调控中的新功能,更首次将核孔运输—RNA加工—组蛋白修饰—免疫转录串联成一条完整的信号链,为理解植物免疫调控提供了全新的分子基础(图3)。在应用层面,CPR5、GBPL3等负调控因子成为理想的抗病育种靶点。通过精准调控这些因子,有望在不牺牲作物产量的前提下,增强其广谱抗病性,为绿色农业提供新策略。
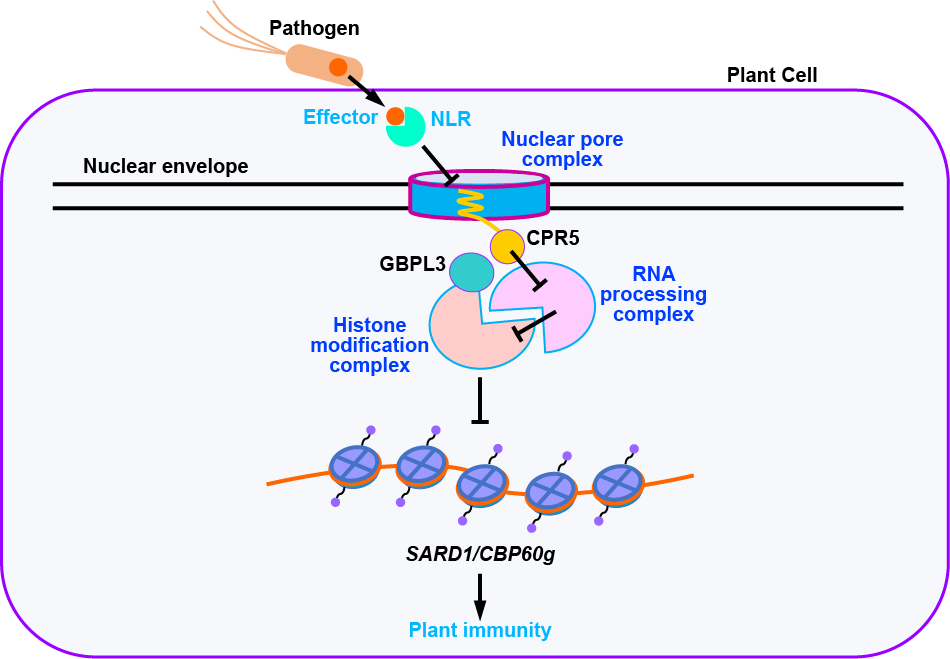
图3. CPR5-RNA加工复合体-GBPL3/组蛋白修饰复合体信号链调控植物免疫的模型
上海师范大学生命科学学院王水研究员为通讯作者,研究生潘镭文、彭顺、张悦慧和常欢为共同第一作者。本科生杨奕、研究生郭东北、郭缘、韩雅坤、毛婷和黄羽辰参与该论文的研究。该研究受到国家自然科学基金面上项目(32270290)和上海植物种质资源工程技术研究中心项目(17DZ2252700)的资助。

王水实验室照片(从左至右)张悦慧、徐峰辉、潘镭文、王水、蔡心一
(供稿、摄影:生命科学学院)












 徐汇校区:上海市徐汇区桂林路100号
徐汇校区:上海市徐汇区桂林路100号