光是调控植物生长发育的关键环境因子,其调控作用贯穿植物整个生命周期。植物通过一系列光受体感知环境中不同光质和光强的动态变化,从而启动精确的光信号转导机制,调控植物生长发育进程。其中蓝光受体隐花素(cryptochrome, CRY)作为介导蓝光信号的光受体,调控植物的光形态建成、光周期开花、气孔发育和开放,DNA双链断裂修复,以及生物节律等重要生理过程。CRY不仅存在于植物中,也广泛分布于包括细菌和哺乳动物在内的其他生物体中。例如,在果蝇中CRY作为光受体调节昼夜节律,在哺乳动物中则作为昼夜节律系统的核心组成部分存在;而在候鸟与蝴蝶等迁徙性动物中,CRY可以感应地球磁场,为其长途迁徙提供导航。在拟南芥中存在2个CRY:CRY1和CRY2。CRY1的主要功能包括促进植物的光形态建成,而CRY2的主要功能包括促进植物的光周期开花。CRY1的信号转导机制涉及与E3泛素连接酶复合体COP1-SPAs的直接互作,并稳定COP1的底物——光信号转导途径中关键的促进光形态建成的转录因子HY5,从而促进光形态建成。然而,HY5是否通过细胞自噬途径发生降解,以及CRY1是否通过调控HY5的自噬降解来促进植物的光形态建成尚不清楚。
近日,我校生命科学学院杨洪全教授团队在植物生物学权威学术期刊The Plant Cell在线发表了题为“Photoexcited CRY1 physically interacts with ATG8 to regulate selective autophagy of HY5 and photomorphogenesis in Arabidopsis”的研究论文(https://doi.org/10.1093/plcell/koaf196),报道了蓝光受体隐花素CRY1通过抑制HY5的选择性细胞自噬来介导蓝光信号促进植物光形态建成的分子机制。

自噬是一种被严格调控的细胞内降解途径,在植物的生长发育、营养重分配以及逆境响应中起着关键作用。尤其是在C和N营养缺乏(−C−N)的情况下,自噬被激活,并通过选择性自噬降解多种信号通路的关键因子调控植物生长发育,帮助植物度过营养缺乏的胁迫。杨洪全教授课题组为了寻找新的CRY1相互作用蛋白,通过酵母双杂交方法筛酵母库筛选到了自噬途径关键蛋白ATG8。拟南芥编码9个ATG8蛋白:ATG8a-i,它们具有较高的氨基酸序列相似性。ATG8(哺乳动物中称为LC3)在选择性自噬中发挥核心作用。当与磷脂酰乙醇胺(PE)发生脂化修饰后,ATG8能够调控自噬的关键阶段,包括自噬体的形成、底物识别以及与液泡的融合过程。ATG8的脂化过程依赖于具有的类E1和类E3酶活性的ATG5和ATG7,因此这两种蛋白是自噬途径中至关重要的组成部分。该研究发现CRY1在酵母双杂交和体外pull-down实验中与9个ATG8都有不同程度的互作。作者选择了被广泛研究的ATG8a和ATG8e进行了进一步研究,发现拟南芥中CRY1以蓝光依赖的方式直接与ATG8a和ATG8e互作。作者通过CRISPR-Cas9基因编辑技术获得了ATG8九突变体atg8n,并发现自噬突变体atg5 atg7和atg8n在黑暗下表现为减弱的暗形态表型,而在光下表现为增强的光形态建成表型,说明自噬通过降解光形态建成正调控因子参与调控光形态建成。遗传分析显示,ATG8以及ATG5/ATG7在调控暗形态建成和光形态建成过程中分别作用于CRY1下游和HY5上游。进一步研究发现,在黑暗条件下,且C和N充足(+C+N)的情况下,HY5只定位在细胞核中,而ATG8同时定位在细胞核和细胞质中。值得注意的是,黑暗且在−C−N条件下,ATG8与HY5发生直接互作,HY5和ATG8可以共同转运至自噬体中,HY5通过自噬途径进行降解,从而促进暗形态建成。而在蓝光照射下,CRY1与ATG8的互作抑制了ATG8与HY5的结合,进而抑制了HY5的核输出以及其与ATG8共同定位于自噬体和最终在液泡中的降解。另外,作者还发现CRY1介导蓝光抑制ATG8的核输出并抑制自噬体的形成,最终抑制HY5的自噬降解。该研究揭示了在黑暗条件下和CN营养缺乏时,HY5可以通过依赖于ATG8的选择性细胞自噬发生降解,以及CRY1通过与ATG8发生蓝光依赖的互作抑制HY5的自噬降解,从而促进植物光形态建成的机制。
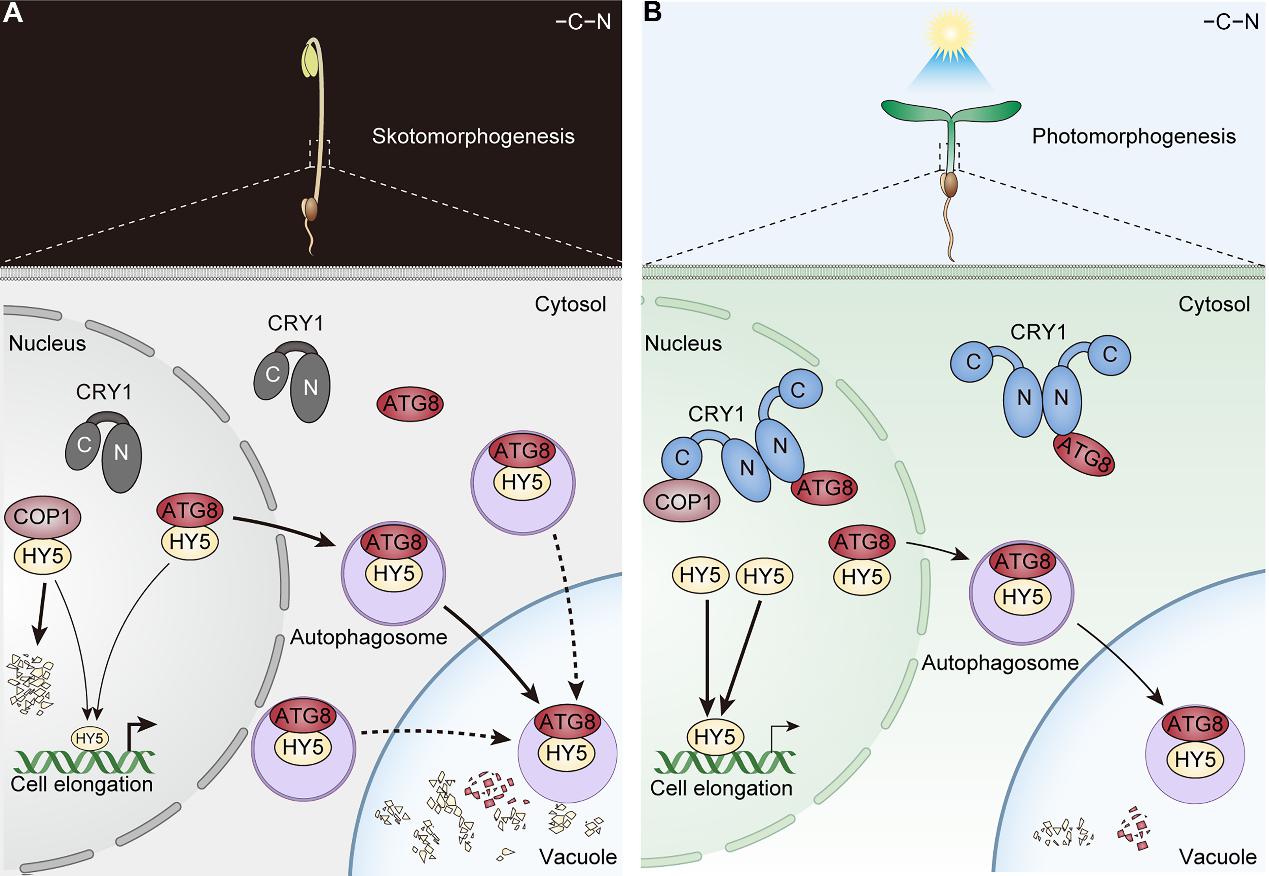
CRY1介导蓝光信号通过抑制HY5的自噬降解来促进植物光形态建成的分子模型图
上海师范大学的博士生江露和张诗龙为该研究工作的共同第一作者,上海师范大学杨洪全教授和王文秀副教授为该论文的共同通讯作者。已毕业的硕士研究生杨光琼、赵家琛、牛雨婷、熊敏妤、谢玲怡和在读硕士研究生刘惠珊共同参与了这项工作。该工作得到了国家自然科学基金、国家重点研发项目、上海市分子植物科学重点实验室和上海市种植资源协调中心的资助。












 徐汇校区:上海市徐汇区桂林路100号
徐汇校区:上海市徐汇区桂林路100号